第9回セミナーレポート ~ICH E17ガイドラインに基づくこれからの医薬品開発~
昨年12月8日(金)最先端医療イノベーションセンター棟マルチメディアホールにて、医療品医療機器総合機構(PMDA)よりICH-E17作成の中心的役割を果たされた、医療情報活用推進室 室長 宇山佳明先生をお迎えし、
第9回アカデミア臨床開発セミナーを開催いたしました。今回のセミナーは「ICH-E17ガイドラインに基づくこれからの医薬品開発」について、実際の項目に沿ってお話しいただきました。

冒頭、「基本原則は元々13項目あったが、余分なものを削っていった結果、7項目まで減った。よって、この1~7項目を忠実に守ると、素敵に医薬品開発が進みます。だからラッキー7です!」とご説明くださいました。とてもアメリカらしい発想で、新設のE17ガイドラインが明るい医薬品開発を示唆しているようで、心に残る言葉となりました。
そして、MRCT (Multi Regional Clinical Trials)において、日本人では効果がでないのには、症例数が少ないなどの可能性もあるため、アジア人という見方をすると、ある程度一貫性のあるデータが得られることがある。そのため、あらかじめ患者さんを確保して試験を組み立てることも今後大切になってくる、などお話くださいました。
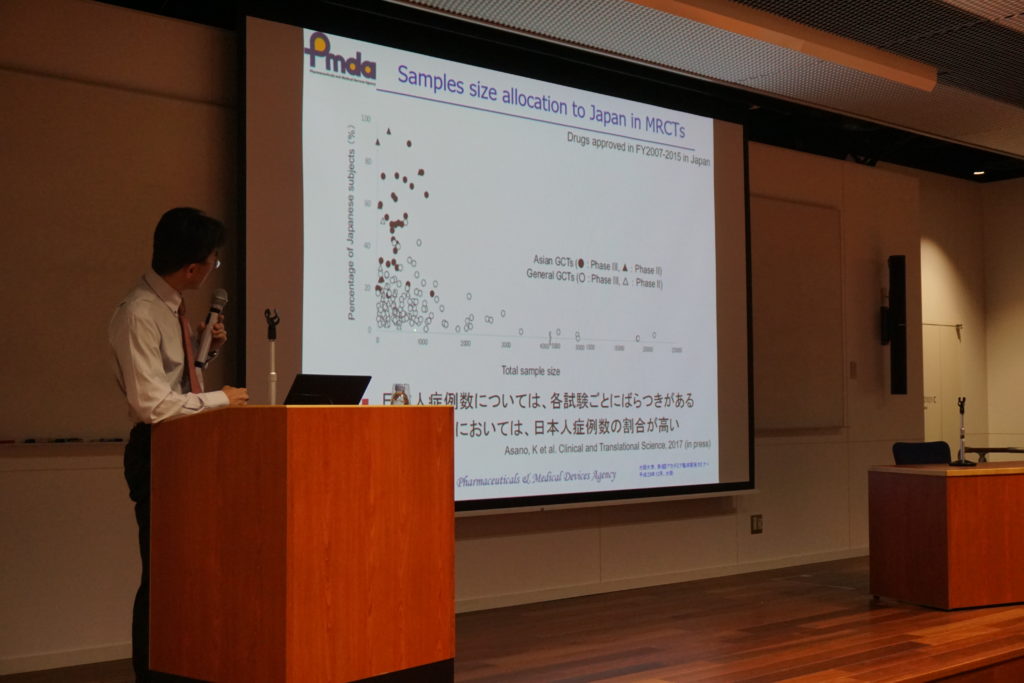
E17ガイドラインの成り立ちを実際のセッションを使って理路整然とご説明くださったことにより、大変分かり易く、これまでは何となくの理解と浸透であったものが、制定されたことによって、非常に良い整理がなされたのではないか、等の前向きなコメントを複数聞くことが出来ました。
実際にE17に深く携わった先生から、直接講演を聞ける機会は滅多にないため、医師を始め、医薬品開発に携わる方々だけでなく、学生そして私たち支援室の様に国際共同臨床研究を推進する立場の者には、各国・地域における独立した臨床試験を必要最小限に抑え、より適切な試験計画を練ることで、国際標準に基づく同時開発の促進につながるのではないかと、再考できる貴重な講義でした。
最後は、ご家族と共に湖のほとりでほほ笑むお写真を、会場の参加者と共有して下さり、アウトドア好きのアクティブな一面を見せていただくなど、和やかな雰囲気で終了いたしました。
第10回アカデミア臨床開発セミナーは、2018年1月30日(火)午後6時より最先端医療イノベーション棟マルチメディアホールにて臨床研究情報センター(TRI)のCDISCコントローラー、竹之内喜代輝先生をお招きし「CDISCの概要とアカデミアに求められる対応」をお話しいただきました。


